Silicon Valley gasta miles de millones de dólares en empresas cuyo objetivo es “hackear” el proceso mismo del envejecimiento y, a la vez, evitar las enfermedades más devastadoras.
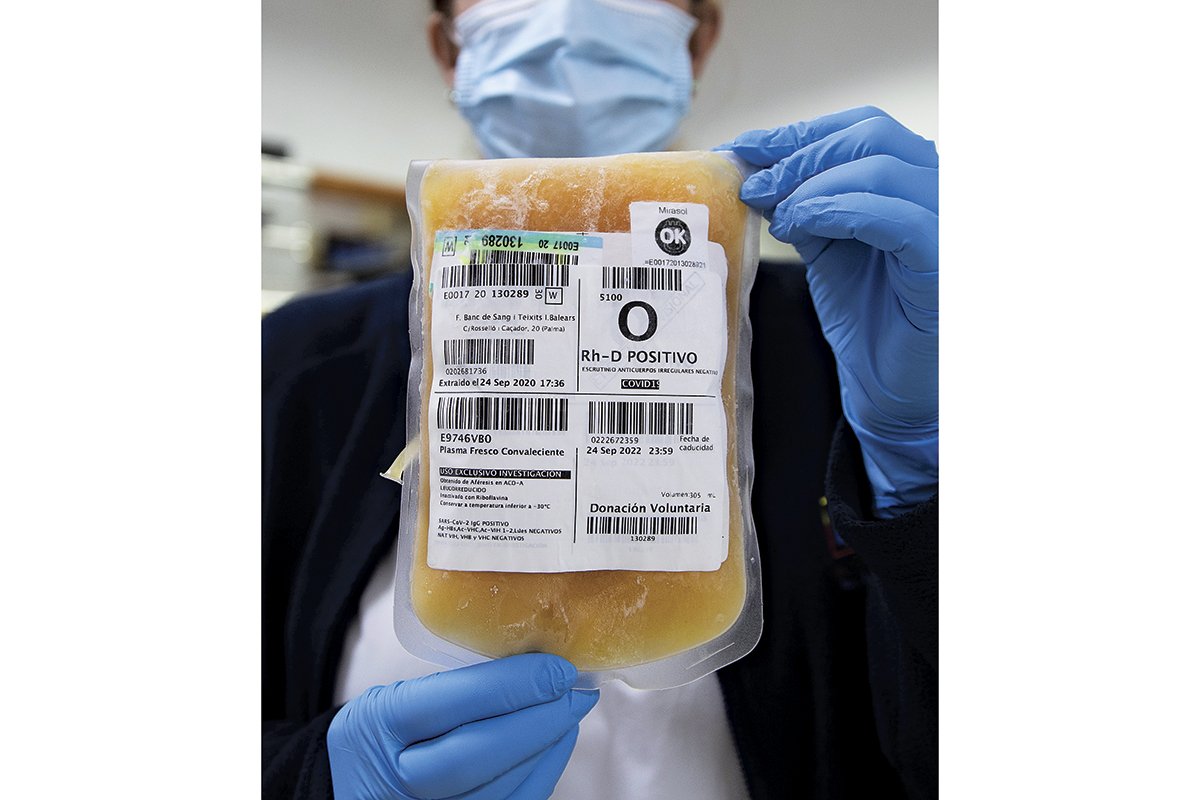
LA EMPRESA española Grifols quizás es más conocida por sus esfuerzos para combatir el covid-19 mediante la cosecha de anticuerpos de la sangre de pacientes recuperados. Para adquirir el plasma sanguíneo necesario para realizar un ensayo clínico, en otoño pasado, Grifols ofreció 100 dólares por transfusión en Estados Unidos, casi el doble de la tarifa actual, y aparentemente, una cantidad lo bastante atractiva como para que algunos estudiantes universitarios emprendedores se expusieran deliberadamente al coronavirus. La Universidad de Brigham Young, en Idaho, respondió amenazando a los estudiantes con suspenderlos si eran sorprendidos tratando de contraer intencionalmente el covid-19.
El tratamiento fracasó en los ensayos clínicos, anunció Grifols a finales de marzo. Sin embargo, las ambiciones de la empresa, con sede en Barcelona, son mucho más altas. Con 289 centros de recolección de plasma únicamente en Estados Unidos, espera extraer algo mucho más valioso del plasma de los jóvenes voluntarios: un conjunto de moléculas microscópicas que podrían revertir el proceso mismo del envejecimiento.
A principios de este año, la empresa logró un acuerdo por 146 millones de dólares para adquirir Alkahest, compañía fundada por Tony Wyss-Coray, neurólogo de la Universidad de Stanford que, junto con Saúl Villeda, reveló en artículos científicos, publicados en 2011 y 2014, que la sangre de ratones jóvenes tenía efectos restauradores aparentemente milagrosos en el cerebro de los ratones más viejos. El descubrimiento se suma a una polémica área de investigación denominada gerociencia, que se centra en la identificación de los elementos beneficiosos en la sangre que se disipan conforme envejecemos, y de otros factores que se acumulan y provocan daños.
También lee: Expertos de EU recomiendan retomar vacuna anticovid de Johnson & Johnson
En los últimos seis años, Alkahest ha identificado más de 8,000 proteínas en la sangre que muestran un potencial terapéutico. Sus esfuerzos, junto con los de Grifols, han dado como resultado al menos seis ensayos en fase II, ya sea completos o en curso, para tratar una amplia variedad de trastornos relacionados con el envejecimiento, como las enfermedades de Alzheimer y de Parkinson.
Alkahest y una creciente cantidad de nuevas empresas de salud dedicadas a la gerociencia muestran un cambio en la forma de pensar sobre algunas de las enfermedades más intratables que enfrenta la humanidad. En lugar de centrarse únicamente en la etiología de enfermedades individuales como las cardiopatías, el cáncer, la enfermedad de Alzheimer y la artritis o, incluso, el covid-19, los gerocientíficos tratan de comprender cómo estas enfermedades se relacionan con el factor de riesgo individual más grande de todos: el envejecimiento humano. Su objetivo es “hackear” el proceso mismo del envejecimiento y, al mismo tiempo, retardar o evitar el inicio de muchas de las enfermedades principalmente asociadas con la senectud.
Por supuesto, la idea de que el envejecimiento y la enfermedad van de la mano no es nueva. Lo que sí es nuevo es la reciente confianza de los científicos en que el “envejecimiento” se puede medir, se le puede aplicar la ingeniería inversa y se puede controlar.
Hasta hace poco, “las personas que trabajaban con las enfermedades no pensaban que el envejecimiento fuera modificable”, señala Felipe Sierra, quien recientemente se jubiló como director de la División de Biología del Envejecimiento, que forma parte de los Institutos Nacionales de Salud de Estados Unidos. “Eso es realmente lo que dicen muchos libros de medicina: el principal factor de riesgo de enfermedad cardiovascular es el envejecimiento, pero no podemos cambiar esto último, así que hablemos sobre el colesterol y la obesidad. En el caso de la enfermedad de Alzheimer, el envejecimiento es el principal factor de riesgo, pero hablemos sobre la acumulación de proteínas betaamiloides en el cerebro. Ahora, esto ha comenzado a cambiar”.
No te pierdas: El Reino Unido registra 32 decesos por coágulos tras aplicar 21 millones de vacunas AstraZeneca
El resultado ha sido un diluvio de dinero invertido, una explosión de investigaciones para descubrir con precisión lo que se deteriora en nuestro cuerpo conforme envejecemos, y la promesa de obtener resultados clínicos del futuro.
En los meses anteriores a la pandemia, muchas personas invirtieron miles de millones de dólares para financiar empresas de biotecnología, cuyo objetivo es comercializar esta nueva ciencia. Algunas empresas de están desarrollando medicamentos y transfusiones diseñadas para eliminar células zombis y desechos metabólicos que se acumulan con la edad. Otras esperan infundir un nuevo vigor a componentes celulares debilitados, como las células madre, o estimular el cuerpo para realizar acciones beneficiosas mediante la adición de hormonas o proteínas poco conocidas cuya producción disminuye conforme envejecemos. El Instituto Nacional sobre el Envejecimiento (NIA, por sus siglas en inglés), bajo el mando de su director, Richard Hodes, recientemente anunció planes para invertir alrededor de 100 millones de dólares en los próximos cinco años para realizar investigaciones básicas con el objetivo de comprender la “senescencia celular”.
“No tienes idea de la cantidad de personas interesadas en invertir su dinero en la longevidad”, afirma Nir Barzilai, director fundador del Instituto para la Investigación del Envejecimiento de la Facultad de Medicina Albert Einstein de la Universidad Yeshiva, y fundador de una empresa enfocada en la salud mitocondrial. “Hay miles de millones de dólares”.
Aunque la gran mayoría de esos esfuerzos aún están en la etapa preclínica de desarrollo, varios se han incorporado recientemente a los ensayos de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) y podrían llegar al mercado en unos cuantos años. Algunos ya están apareciendo en el mercado semiclandestino, lo que ha provocado la preocupación de que charlatanes estén vendiendo supuestos productos milagrosos contra el envejecimiento. Mientras tanto, a otras personas les preocupa lo que podría ocurrir si esos medicamentos realmente cumplen lo que prometen: ¿acaso los jóvenes pobres se verán obligados a vender su sangre a multimillonarios envejecidos? ¿Las píldoras mágicas antienvejecimiento serán patrimonio exclusivo de los ricos de Park Avenue y Hollywood, como lo son actualmente las cirugías plásticas, los injertos de cabello y las inyecciones de bótox? ¿El resto de nosotros, simples mortales envejecidos, nos veremos obligados a mirar cómo ellos revierten su envejecimiento mientras nosotros nos marchitamos y morimos?
Lee: Coronavirus: cómo Taiwán logró combatir con éxito la pandemia sin hacer confinamientos
“HACKEAR” EL ENVEJECIMIENTO
El envejecimiento no suele terminar bien. A pesar de los grandes incrementos en la expectativa de vida en los seres humanos (en los últimos 150 años, dicha expectativa casi se ha duplicado en muchos países desarrollados, aunque se redujo en el último año debido a la pandemia), aún no hemos podido encontrar una forma de detener el daño implacable que el tiempo impone a nuestro cuerpo.

Cuando envejecemos, nuestro sistema inmune comienza a averiarse y a generar un estado de inflamación de bajo nivel que suprime la regeneración celular y produce los achaques característicos de la edad. Quizá vivamos más, pero lo hacemos con dolor. Conforme nuestras mitocondrias dejan de producir energía para nuestras células de manera efectiva, pasamos muchos de esos años que con tanto trabajo hemos ganado tomando siestas vespertinas. Conforme nuestras células madre se vuelven más letárgicas e inactivas, nuestra masa muscular se reduce y nuestros huesos se vuelven cada vez más frágiles. En pocas palabras, nuestro cuerpo se desintegra.
El primer indicio de que la biología del envejecimiento podía “hackearse” se produjo, de manera improbable, en una serie de experimentos de laboratorio sobre una humilde especie de ascárides. A fines de la década de 1980 y principios de la de 1990, en varios estudios con gemelos idénticos se había demostrado que alrededor de 30 por ciento de la longevidad en los seres humanos podía atribuirse a factores genéticos. Sin embargo, la mayoría de los científicos creía que el proceso del envejecimiento era un fenómeno demasiado complejo como para modularlo simplemente ajustando un par de genes o tomando una píldora.
Entonces, en 1993, Cynthia Kenyon, bióloga de la Universidad de California, en San Francisco, duplicó la esperanza de vida de un gusano, de tres a seis semanas, mediante la mutación de un solo gen. Su trabajo indicaba la posibilidad de elaborar medicamentos que pudieran aumentar la longevidad sin atacar enfermedades específicas. Indicaba también que el proceso mismo del envejecimiento podía ser manipulado.
En esa época, un grupo marginal de entusiastas de la longevidad ya trataban, sin saberlo, de hacer lo que hizo Kenyon con las ascárides mediante la práctica de la restricción de calorías. Esta idea adquirió impulso cuando el gerontólogo Roy Walford, de la Universidad de California, en Los Ángeles, duplicó la esperanza de vida de varios ratones de laboratorio restringiendo su consumo de calorías, y posteriormente se convirtió en un abierto defensor de esa práctica en los seres humanos. Escribió una serie de exitosos libros en la década de 1980 y adoptó una dieta de 1,600 calorías diarias durante los últimos 30 años de su vida. Actualmente, aún puede verse a algunos de sus demacrados acólitos en las conferencias sobre longevidad, pesando meticulosamente sus alimentos durante las pausas para comer.
Actualmente, varios descubrimientos científicos recientes explican por qué este método de “biohackeo” podría tener algo de verdad. En los seres humanos, la insulina es la señal hormonal que le indica a nuestras células que absorban el azúcar y la conviertan en energía. Junto con una hormona estrechamente relacionada que se denomina factor de crecimiento insulínico tipo 1 (IGF1, por sus siglas en inglés), la insulina influye en una gran cantidad de procesos celulares, entre ellos, el índice de división celular, que de acuerdo con muchos investigadores, se relaciona directamente con el envejecimiento. Cuando la insulina y el IGF1 en los seres humanos o los componentes análogos de los gusanos se reducen debido a que estamos hambrientos o a que los genes han sido modificados, una gran cantidad de mecanismos de reparación celular que normalmente se encontraban en reposo se ponen de inmediato a trabajar a todo vapor.

Esta adaptación tiene sentido desde el punto de vista de la evolución. En los tiempos prehistóricos se producían largas temporadas de escasez intercaladas con preciosos periodos de abundancia. Ya que no había manera de decir cuánto durarían los buenos tiempos, nuestros ancestros desarrollaron la capacidad de generar y acumular grasa y músculo tan rápidamente como fuera posible. Un festín hacía que el cuerpo liberara insulina e IGF1, lo que permitía que nuestras células comenzaran a absorber glucosa y las estimulaba para emplear energía en la reproducción y regeneración celular durante todo el tiempo en que nuestros niveles de insulina permanecieran altos.
Cuando las calorías ya no eran fáciles de obtener, nuestros cuerpos se ajustaban al disminuir sus concentraciones de insulina e IGF1, lo cual es una indicación para que nuestras células ralenticen sus procesos de regeneración y reproducción, y dirijan la energía a los procesos celulares con mayores probabilidades de facilitar nuestra supervivencia en las épocas de frío y escasez. El cuerpo humano protege las células que ya posee: produce más enzimas para asegurarse de que las proteínas no se plieguen incorrectamente, acelera la maquinaria diseñada para reparar el ADN roto y divide los desechos celulares y las células defectuosas que, en otras circunstancias, podría pasar por alto, detectando las partes que puede utilizar para alimentar sus células sanas en las épocas de escasez. En el proceso, limpia la basura celular que, particularmente conforme envejecemos, es probable que promueva una inflamación de bajo nivel.
Actualmente, no existe ninguna indicación aprobada por la FDA para ningún medicamento que aborde el proceso de envejecimiento en sí mismo. Para obtener su aprobación, los medicamentos deben hacer frente a una enfermedad específica. No es coincidencia que algunos gerontólogos hayan elegido a la metformina, el popular medicamento para la diabetes, como la “plantilla” para la creación de una nueva clase de medicamentos antienvejecimiento aprobados por la FDA. Dicho medicamento funciona al influir en la sensibilidad del cuerpo ante la insulina y puede tener un efecto en el ritmo del gasto metabólico y energético. Si los estudios que actualmente se realizan confirman su eficacia y obtiene la aprobación de la FDA, podrían marcar el inicio de una categoría regulatoria completamente nueva de medicamentos que, en lugar de tratar enfermedades específicas, funcionarán para evitar que nuestros cuerpos se deterioren aún más una vez que hayamos contraído alguna de estas enfermedades.

“El envejecimiento favorece la enfermedad”, afirma Barzilai, de la Facultad Albert Einstein, que dirige el estudio. “Ese es nuestro argumento. Si detenemos el envejecimiento, este dejará de favorecer la enfermedad”.
Actualmente podría estar en camino una gran cantidad de posibles medicamentos antienvejecimiento. A principios de la década de 2000, un grupo de biólogos moleculares descubrió otra forma importante de manipular el proceso de envejecimiento al cultivar cepas de levadura, moscas de la fruta y gusanos para prolongar su vida. Estos científicos secuenciaron los genomas de las cepas más resistentes y después trabajaron en sentido inverso para identificar las variantes genéticas específicas que parecían relacionarse con un aumento en la longevidad. Esto los llevó a la molécula mTOR, una variante genética que sirve como blanco de un medicamento antienvejecimiento llamado rapamicina, que actualmente está sometido a ensayos clínicos. Entre esos esfuerzos científicos se encuentra un enorme estudio longitudinal de envejecimiento canino en la Universidad de Washington, en el que participan 30,000 perros, y en el que se planea seleccionar a 500 afortunados cachorros para que participen en un ensayo con rapamicina.
La cacería de otras “palancas de control” que podrían accionarse mediante fármacos continúa en instituciones de investigación de todo el mundo. Un tercer enfoque aumentaría la producción de una enzima llamada AMP-quinasa, que modula procesos celulares como el crecimiento y el metabolismo con base en la cantidad de energía disponible para su consumo. En años recientes también han surgido como otro blanco promisorio, junto con muchas otras moléculas, hormonas y proteínas que parecen declinar con la edad y que desempeñan una función clave en la reparación, regeneración, protección y funcionamiento eficiente de las células.
Vera Gorbunova, codirectora del Centro Rochester de Investigación sobre el Envejecimiento de la Universidad de Rochester, y sus colegas compararon 18 especies de roedores, entre ellas, castores, hámsteres y ratones, las clasificaron según su longevidad y las analizaron para buscar patrones interesantes. De manera significativa, descubrieron que una reparación “más firme” de los daños en el ADN, que conforma los planos a escala molecular que se encuentran en cada una de nuestras células, parece coevolucionar con la longevidad. En otras palabras, las especies que viven más tiempo tienen una capacidad más sólida de reparar el tipo de problemas que ocurren inevitablemente con la edad. La investigación fue publicada recientemente en la revista Cell.
“Se observó una correlación muy sólida entre el tiempo que vive cada especie y qué tan bien repara sus daños en el ADN”, afirma Gorbunova. “También investigamos por qué es mejor. Encontramos una proteína que es muy importante para la reparación del ADN y que se encuentra más activa en las especies que viven más tiempo”.
Gorbunova ha realizado parte de su trabajo más emocionante con una oscura superestrella del campo de la longevidad, conocida como rata topo desnuda, un roedor sin pelo y de piel arrugada con un par de incisivos parecidos a los del castor y que vive en túneles del este de África. La rata, a la que a veces se le llama por su nombre cariñoso de “perrito de la arena”, tiene una esperanza de vida inusualmente larga: 30 años, es decir, diez veces más que su primo cercano, el ratón de campo de América del Norte, que pocas veces vive más de tres años.
Para Gorbunova, gran parte de la resistencia de las ratas topo es la abundancia de ácido hialurónico, que es un importante componente de la piel que participa en la regeneración de los tejidos. Aunque los ratones y los humanos también tenemos ácido hialurónico, los tejidos de las ratas topo desnudas están “saturados de este ácido”, afirma Gorbunova. Además de tener fuertes propiedades antioxidantes y otras que parecen atenuar las consecuencias destructivas de la inflamación crónica y generalizada que suele acumularse con edad, la abundancia de ácido hialurónico también parece evitar el crecimiento de células cancerosas malignas.
“El tema del ácido hialurónico es muy agradable debido a que podemos ver la posibilidad de traducirlo a los seres humanos”, dice Gorbunova. “Lo tenemos, pero no tenemos mucho, así que pienso que hay oportunidades de mejora. Podemos hallar maneras de aumentar nuestras concentraciones de ácido hialurónico”.
De acuerdo con Gorbunova, las diferencias entre el ratón y la rata topo desnuda se explican fácilmente desde el punto de vista evolutivo: sus respectivas adaptaciones están enfocadas a aumentar sus oportunidades de éxito reproductivo. “Para un ratón, la mejor estrategia para tener más progenie es ser muy, muy prolífico de manera muy rápida porque entonces alguien se lo comerá, así que no tiene la oportunidad de vivir más tiempo”, explica. “La rata topo desnuda vive bajo tierra y tiene muy pocos depredadores. Además, se reproduce en etapas muy tardías de su vida. Así que desarrolló un mecanismo que le permite vivir más tiempo y respirar tanto como le sea posible simplemente porque puede. No hay nadie que quiera comérsela. Y cuanto más tiempo viva, más progenie tiene”.
La misma lógica se aplica a los seres humanos, y también explica por qué nuestros cuerpos se deterioran. Actualmente, muchos gerontólogos afirman que las enfermedades del envejecimiento son la consecuencia natural de los avances en la esperanza de vida actual, que actualmente se extiende varias décadas más allá de la edad reproductiva, por lo que no ha estado sujeta al mismo modelado evolutivo exquisitamente eficiente que podría aumentar nuestras probabilidades de vivir todo ese tiempo. “Si vemos este trabajo desde un punto de vista evolutivo, no deberíamos vivir tanto tiempo”, afirma Gerard Karsenty, que encabeza el Departamento de Genética y Desarrollo del Centro Médico de la Universidad de Columbia. “El envejecimiento es una invención del género humano. Ninguna especie animal ha engañado con éxito a su propio cuerpo, lo que equivale a engañar a la naturaleza, excepto el género humano. Los elefantes pueden vivir 100 años, pero ya vivían 100 años hace un millón de años. Los seres humanos hemos logrado ser más listos que nuestro propio cuerpo”.
Pero, ¿qué tiene que ver todo esto con la sangre joven de Wyss-Coray y Villeda?
REGENERACIÓN
Actualmente, Saúl Villeda dirige un laboratorio en la Universidad de California, en San Francisco, situado en una colina desde la que puede verse la famosa zona de Haight-Ashbury de San Francisco. Una escalera de caracol conduce a un pasillo subterráneo iluminado con luces fluorescentes y a un estrecho conjunto de cuartos atiborrados de jaulas para ratones. Los ratones del cuarto tienen algo inusual. Se desplazan por sus jaulas con dos cabezas, dos juegos de piernas y cuerpos del doble de ancho.

Estos ratones doblemente anchos son producto de un macabro procedimiento conocido como “parabiosis”, una técnica que Villeda llegó a dominar cuando era estudiante de posgrado en el laboratorio de Wyss-Coray para el improbable experimento que condujo a la fundación de Alkahest y a los ensayos clínicos de sangre con el fin de tratar el envejecimiento. En el procedimiento, realizado por primera vez en el siglo XIX por el científico francés Paul Bert, se mezclan los sistemas circulatorios de dos roedores al abrir sus cuerpos y unirlos por las heridas de manera que sus cuerpos se fusionen conforme sanan.
Para aprenderlo, Villeda tuvo un maestro experto: Thomas Rando, un neurólogo que estudia la longevidad y ocupa la oficina contigua a la de Wyss-Coray. Rando tuvo por primera vez la idea de revivir la oscura técnica a principios de la década de 2000. Había llegado a creer que una de las razones por las que nuestro cuerpo pierde sus poderes regenerativos conforme envejecemos es que nuestras células madre dejan de recibir las señales a escala molecular que necesitan para activarse. Rando ignoraba cuáles podrían ser esas señales. Pero sabía dónde encontrarlas: la sangre de ratones más jóvenes. Y es aquí donde entra la parabiosis.
Para probar su hipótesis, Rando unió ratones viejos con otros más jóvenes de manera que compartieran el mismo aparato circulatorio, y luego puso a prueba su capacidad para sanar pequeñas heridas. Los resultados fueron muy notables. Los ratones más viejos pudieron reparar pequeños desgarros musculares mucho más rápido que sus pares no unidos a ratones más jóvenes. Por otra parte, los ratones más jóvenes sanaron mucho más lentamente de lo normal.
Los resultados fueron muy emocionantes. En ellos se indicaba que las células madre podían revitalizarse simplemente al reintroducir en el torrente sanguíneo las moléculas que podían activarlas, y que están presentes en la sangre joven. El siguiente paso fue encontrar los factores sanguíneos que fomentan la juventud y que son responsables del cambio. Pero esto no sería fácil.
“Es la mayor expedición de pesca que te puedas imaginar”, advirtió Rando en aquel momento, y señaló los miles de proteínas, lípidos, azúcares y otras pequeñas moléculas que se encuentran en el suero sanguíneo.
Al ver cómo se desarrollaba todo esto en la puerta de al lado, Wyss-Coray, que estudió la enfermedad de Alzheimer, y el entonces estudiante de posgrado Villeda dudaban que pudieran inducir un rejuvenecimiento similar en el cerebro. Cualquiera que fuera el elemento de la sangre joven que fomentaba la regeneración parecía poco probable que pudiera atravesar la barrera hematoencefálica, que es el límite semipermeable que evita que la sangre circulante, y gran parte de la carga que lleva, entren en el sistema nervioso central. “Sin embargo, lo hicimos de todos modos, debido a que yo era un estudiante de posgrado en esa época, y Tony siempre apoya las ideas locas”, recuerda Villeda.
Después de unir ratones viejos y jóvenes, Villeda sacrificó a los más viejos, cortó sus cerebros en rebanadas muy delgadas y las tiñó con un tinte especial que se enlaza con las neuronas nacientes. Entonces, contó el número de nuevas neuronas y lo comparó con los niveles normales de crecimiento neuronal en los ratones de edad similar. Cuando se publicaron en 2014, los resultados sacudieron al mundo científico. La transfusión de sangre nueva produjo un incremento de 300 por ciento en el número de nuevas células nerviosas generadas en el cerebro de los ratones más viejos. Sin embargo, esa no fue la única revelación. El científico ya había demostrado que los miembros más jóvenes de las parejas unidas de ratones jóvenes y viejos generaban muchas menos células nerviosas nuevas que los ratones jóvenes que vagaban libremente, sin estar unidos a sus primos más viejos. Y aunque los ratones viejos se volvieron más vigorosos, los más jóvenes se comportaron repentinamente como si fueran ratones maduros.
Dado que la parabiosis no es una opción para los pacientes humanos, Villeda y Wyss-Coray tratan de realizar el mismo truco con una simple transfusión de plasma sanguíneo. También en este caso, los resultados fueron mejores de lo esperado. En las tareas de navegación espacial, como hallar una plataforma subacuática para apoyarse en una cámara llena de agua, los ratones jóvenes que recibieron inyecciones de “sangre vieja” tuvieron un desempeño mucho peor que el grupo que recibió inyecciones de plasma de ratones más jóvenes. Por su parte, una vez que recibieron la transfusión de sangre de ratones jóvenes, los ratones de sangre vieja pudieron localizar la plataforma tan fácilmente como sus pares más jóvenes.
Los resultados llegaron a los titulares de todo el mundo. Y pronto, Wyss-Coray y Villeda, su protegido, comenzaron a recibir muchos correos electrónicos extraños, y a veces, macabros. Una escalofriante misiva provenía de un hombre que ofrecía proporcionar toda la sangre que Wyss-Coray pudiera necesitar para su experimento; afirmaba que podía obtener sangre de niños humanos de cualquier edad. También hubo una gran cantidad de sentidos ruegos de pacientes con Alzheimer y sus seres queridos que solicitaban pruebas en humanos, desesperados por evitar el implacable avance de esa enfermedad degenerativa e incurable.
La consulta que le cambió la vida a Wyss-Coray provino de la familia del recientemente fallecido multimillonario chino Chen Din-hwa, también conocido como “el rey del hilo de algodón”, de Hong Kong, por la empresa de comercio de hilos que estableció en 1949.
En su lecho de muerte, con una enfermedad de Alzheimer avanzada, Din-hwa, de 89 años, recibió transfusiones de plasma sanguíneo para tratar una enfermedad no relacionada. Su nieto Vincent le contaría más tarde a Wyss-Coray que, en las siguientes horas, el anciano adquirió un sorprendente estado de alerta y coherencia, lo que permitió que sus seres queridos tuvieran unos invaluables momentos finales de conexión con él. Al parecer, la sangre joven tuvo un efecto notablemente restaurador en el anciano, justo como lo tuvo en los ratones de Wyss-Coray.
Tras la muerte de Din-hwa, en 2012, Vincent, biólogo molecular de la Universidad de California, en Berkeley, trató de explicar el extraño fenómeno. Finalmente, encontró el primer artículo de Wyss-Coray y Villeda sobre los ratones.
Wyss-Coray se enteró a través de un conocido mutuo de la industria de la biotecnología. “Me dijo: ‘Tony, hay una persona muy rica de Hong Kong ‒recuerda Wyss-Coray‒. ‘Quiere iniciar una compañía. ¿Te interesa?’”.
Vincent y Wyss-Coray formaron Alkahest, una empresa de biotecnología con sede en San Carlos que había obtenido más de 150 millones de dólares de la empresa familiar de Din-hwa, el Grupo Nan-Fung, la Universidad de Stanford, la Fundación Michael J. Fox y Grifols, la enorme empresa española de plasma sanguíneo que acabaría adquiriendo a todas las demás.
El verdadero trabajo de descubrir con precisión cuál era el elemento en la sangre que provocaba esta transformación apenas comenzaba.
LA QUÍMICA DEL ENVEJECIMIENTO
En los años que siguieron a los primeros experimentos con ratones, Villeda, Wyss-Coray y otros investigadores independientes han identificado varias proteínas que parecen tener efectos restauradores promisorios o bien, efectos nocivos en la sangre de los ratones viejos. Ambos tipos podrían ser útiles como posibles blancos de medicamentos. Si el ADN es el plano del cuerpo, las proteínas son sus materiales de construcción. Esas moléculas esenciales, compuestas de aminoácidos, no solo son el material fundamental con el que construimos nuestros huesos, piel, músculos y neuronas. También son las unidades que se utilizan para elaborar hormonas y otros elementos señalizadores a escala molecular que transmiten mensajes de una parte del cuerpo a otra. Al parecer, con la edad, muchas de las proteínas que necesitamos para funcionar eficientemente declinan, mientras que las proteínas que no son buenas para nosotros se acumulan en sitios poco convenientes y entorpecen el funcionamiento de nuestro cuerpo.
Villeda ha aislado una molécula presente en los ratones que bloquea la regeneración de las neuronas cerebrales y promueve el deterioro cognitivo. Dicha molécula parece estar relacionada con el deterioro gradual y relacionado con la edad del sistema inmune, y si se inyectan en el torrente sanguíneo de ratones jóvenes, estas moléculas proinflamatorias son capaces de dañar la cognición. Y en mayo de 2019, Wyss-Coray demostró que era posible bloquear la actividad de otra proteína que se acumula con la edad, desencadenando un poderoso efecto restaurador y mejorando en gran medida el desempeño de ratones viejos en pruebas de memoria y capacidades cognitivas.
Por otra parte, Villeda descubrió recientemente una proteína que promueve el aprendizaje y la memoria en los ratones jóvenes. Karsenty, de la Universidad de Columbia, ha identificado una poderosa hormona que previene la depresión y mejora la memoria, entre otras cosas, pero que parece declinar con la edad. En los seres humanos, la concentración de la hormona disminuye precipitadamente después de los 50 años.
No sabemos si las fracciones sanguíneas de Alkahest o cualquier otro medicamento superarán los ensayos clínicos. Sin embargo, parece probable que el primero de una nueva clase de medicamentos sea aprobado muy pronto.
En 2019, en una conferencia médica, Alkahest presentó resultados preliminares de ensayos clínicos de fase II, cuyo objetivo es establecer datos iniciales de dosificación, pero que también pueden revelar información sobre si un medicamento funciona en una pequeña población de pacientes, y cómo lo hace. Los resultados indican que las transfusiones de plasma sanguíneo ralentizan el deterioro cognitivo y funcional en pacientes que padecen la enfermedad de Alzheimer en un grado de leve a moderado. Los estudios en ratones indican que la sangre favorece el crecimiento de nuevas neuronas y disminuye la neuroinflamación. La empresa también tiene ensayos en varias fases de desarrollo para tratar la enfermedad de Parkinson, la demencia y favorecer la recuperación postoperatoria, y ha aislado una variedad de moléculas presentes en la sangre vieja, las cuales planea modular mediante el uso de medicamentos.
Además de los ensayos de Alkahest con fracciones sanguíneas, se han comenzado a realizar pruebas con una nueva clase de medicamentos “antienvejecimiento” denominados “senolíticos”, cuyo objetivo es eliminar las células “zombis” senescentes que se acumulan con la edad. Las células senescentes son aquellas que han dejado de dividirse y segregan factores proinflamatorios que suprimen los mecanismos normales de reparación celular y generan un ambiente tóxico para las células vecinas. Unity Biotech, la empresa más prominente que comercializa ese mecanismo, recaudó más de 220 millones de dólares y comenzó a cotizar en NASDAQ en 2018. Aunque su medicamento para la osteoartritis de la rodilla fue eliminado tras unos decepcionantes ensayos de fase II, actualmente está en desarrollo otro medicamento senolítico para el tratamiento del deterioro visual relacionado con la edad; se espera que los resultados de los ensayos de fase I sean publicados en julio.
Existen otros medicamentos en desarrollo. En los días anteriores al inicio del covid-19, científicos de 14 instituciones de investigación de todo Estados Unidos reclutaban a 3,000 individuos de entre 65 y 79 años de edad para participar en un estudio de seis años de duración, con un costo de 50 millones de dólares, conocido como ensayo TAME (Targeting Aging with metformin, abordar el envejecimiento con metformina, el medicamento para la diabetes). El objetivo de dicho estudio es demostrar que la metformina puede retrasar el inicio de enfermedades crónicas relacionadas con la edad, como las cardiopatías, el cáncer y la demencia en las personas que ya han sido afectadas. Barzilai, que coordina el estudio, afirma que él y sus colegas no han puesto en marcha este esfuerzo “para que todo el mundo comience a tomar metformina, sino porque necesitamos que se apruebe la indicación clínica”.

De todos los medicamentos candidatos, la metformina es quizá la que tiene la trayectoria más establecida en los seres humanos, al menos, en aquellos con diabetes. “Lo bueno de la metformina es que la hemos tenido con nosotros durante 60 años”, señala Barzilai. “Es uno de los medicamentos más seguros y baratos”.
EL LADO OSCURO DE UNA LARGA VIDA
A pesar de la emoción, es demasiado pronto para celebrar. Los datos sobre la efectividad de la metformina en las personas sanas no son definitivos. Y los senolíticos y las fracciones de plasma sanguíneo no han sido probadas en una población amplia de pacientes.
No es probable que esto evite que las personas capitalicen la expectación para aprovecharse de los pacientes más vulnerables. Se sabe que algunos pacientes con cáncer, desesperados por encontrar una cura, viajan a México o a oscuras islas tropicales para someterse a peligrosos tratamientos no comprobados con células madre.
En 2016, un antiguo estudiante de la Facultad de Medicina de Stanford, llamado Jesse Karmazin, inauguró Ambrosia, una clínica en Monterey, California, donde ofrecía a sus clientes transfusiones con la sangre de donadores de entre 16 y 25 años de edad por 8,000 dólares el litro. En diciembre de 2018, HuffPost publicó una investigación donde afirmaba que el único paciente que habló públicamente sobre las transfusiones de Ambrosia, un tratamiento que esperaba le pudiera ayudar a vivir más sano hasta su vejez, murió a los 65 años tras sufrir un paro cardiaco.
La FDA emitió una advertencia dos meses después, donde alertaba a los consumidores de la tercera edad que “no debían suponer que [esas transfusiones] son seguras o efectivas”, y que se debía disuadir encarecidamente a los consumidores de “someterse a estos tratamientos fuera de ensayos clínicos supervisados por un consejo institucional adecuado y con un control regulatorio”.
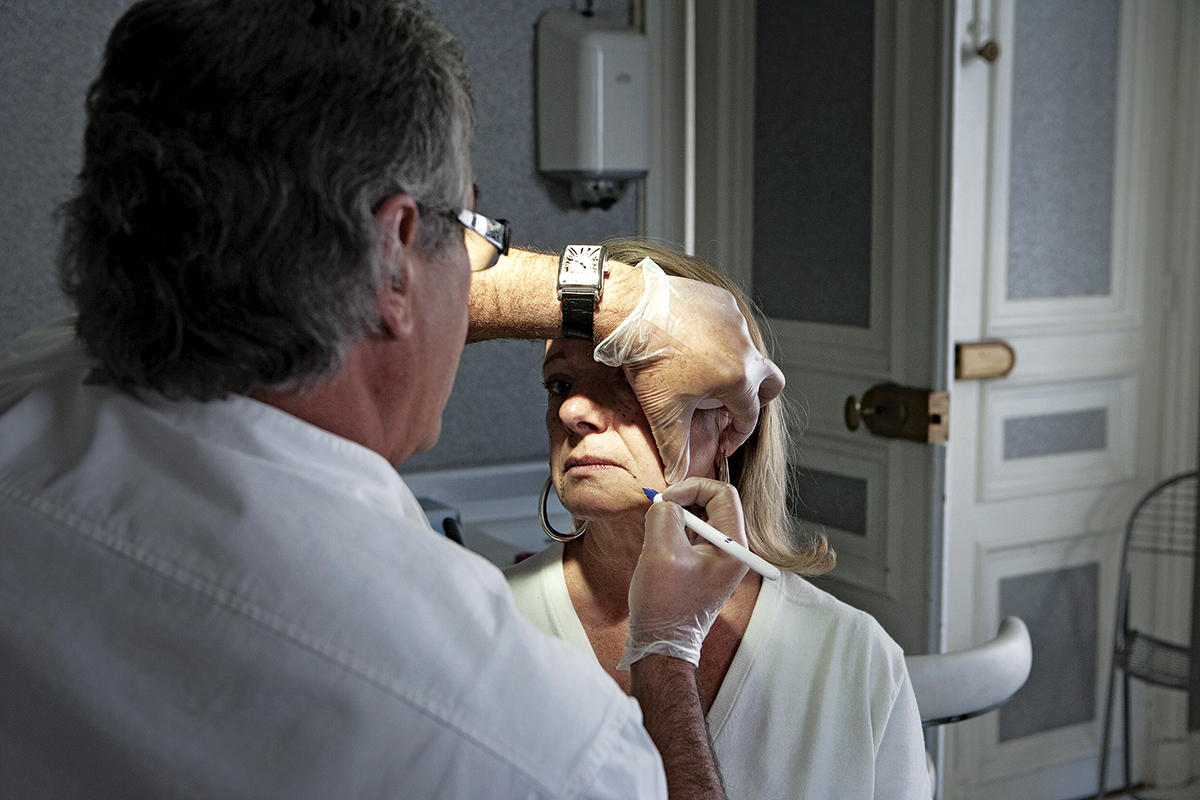
Business Insider informó en agosto de 2019 que Karmazin cerraría Ambrosia. Sin embargo, para noviembre ya había colgado un nuevo letrero, Ivy Plasma, que ofrecía tratamientos “no convencionales” con sangre joven y volvió a hacer que los funcionarios de salud pública y los científicos hicieran sonar las alarmas. Este es un ejemplo perfecto de una intervención cuya eficacia se ha demostrado en ratones, pero no en seres humanos, señala Matt Kaeberlein, catedrático de patología de la Universidad de Washington en Seattle.
Kaberlein, que ha puesto en marcha lo que, según sus expectativas, podría convertirse en un estudio longitudinal con 100,000 sujetos sobre el envejecimiento canino, al tiempo que también realiza un estudio a gran escala sobre la efectividad de la rapamicina para extender la vida de perros envejecidos, afirma que hay “una tonelada de dinero” que fluye hacia esa área, así como “varios ensayos e intervenciones promisorias”. Sin embargo, hasta ahora ninguno de ellos ha logrado cumplir con el estricto requisito establecido por la FDA: un amplio ensayo clínico de fase III que arroje pruebas de que los pacientes mejoran de manera significativa y que los efectos colaterales no superan los posibles beneficios. Es difícil saber cuándo ocurrirá esto: la pandemia de coronavirus ha interrumpido los ensayos y ha desviado la atención hacia el covid-19.
Si los científicos logran tener éxito, el “hackeo” del envejecimiento planteará cuestiones éticas muy problemáticas, particularmente en lo relacionado con la sangre joven. Tras la publicación de esos primeros documentos, en la popular serie de televisión Silicon Valley se difundió un episodio en el que un acaudalado multimillonario de las empresas punto com tenía su propio “chico de la sangre” que lo seguía a todas partes para proporcionarle transfusiones. “La idea de que solo las personas viejas y ricas pueden darse el lujo de obtener sangre joven simplemente es incómoda”, afirma Barzilai.
La mayoría de los gerocientíficos desaconsejan el autotratamiento. Señalan que sería imprudente comenzar a tomar rapamicina, metformina y otros suplementos que se encuentran en el mercado, los cuales no han sido probados y prometen grandes efectos. Por ahora, las únicas curas comprobadas para el antienvejecimiento siguen siendo las de siempre: hacer ejercicio con regularidad, dormir bien y consumir una alimentación saludable. N
—∞—
Publicado en cooperación con Newsweek / Published in cooperation with Newsweek
















































