Si de algo podemos estar seguros es de que todos moriremos algún día. Como es natural, esta inevitabilidad ha llevado a muchos a soñar con una vida inmortal que nos permita permanecer aquí muchos cientos de años. Sin embargo, aunque los humanos no hemos podido quitarnos los grilletes de una existencia finita, el mundo natural alberga muchos otros seres que, al menos en apariencia, son capaces de infringir las leyes de la naturaleza y postergar la inevitable visita de la muerte. Esos animales, que incluyen ajolotes, hidras, medusas y otros más, poseen mecanismos que les permiten prolongar sus vidas y que, tal vez un día, nos ayuden a prolongar las nuestras.
“Hay muchos organismos que no envejecen, o que lo hacen tan lentamente que no podemos detectar el envejecimiento. Entre ellos se cuentan los peces roca o rocotes [Sebastes borealis], las langostas, los esturiones, las microscópicas hidras y ciertos tiburones”, dice a Newsweek el Dr. John K. Davis, profesor de filosofía y bioética en la Universidad Estatal de California, en Fullerton, en Estados Unidos. “De hecho, algunas colonias de coral tienen más de 20,000 años de antigüedad. Y las bacterias tampoco envejecen; solo se dividen para producir descendencia en un proceso que se repite indefinidamente”.

LOS ANIMALES Y EL ENVEJECIMIENTO
El envejecimiento humano es consecuencia de una combinación de factores que incluyen la degradación paulatina de los cromosomas y la pérdida progresiva de células madre, dos procesos que contribuyen a nuestra incapacidad para reparar las células. Esto, a su vez, conduce al envejecimiento del cuerpo y sus sistemas: lo que conocemos como senescencia. Así pues, a fin de traspasar los límites que marcan nuestras breves vidas, tenemos que encontrar la manera de impedir dichos procesos.
“Por lo pronto, los científicos que estudian el envejecimiento no han llegado a un consenso en cuanto a las causas”, comenta el Dr. David Gems, genetista y profesor de biogerontología y envejecimiento en University College, Londres, Reino Unido. “Una hipótesis que ha persistido durante mucho tiempo es que el envejecimiento se debe a la acumulación de daños. Por consiguiente, los organismos que no envejecen tienen una excelente capacidad para repararse”.
EL TIBURÓN DE GROENLANDIA
Algunos animales pueden vivir periodos excepcionalmente largos, como es el caso del tiburón de Groenlandia [Somniosus microcephalus]. Estos apacibles gigantes alcanzan una longitud de entre 2.5 y 7 metros; viven en las aguas gélidas y profundas de los océanos Ártico y Atlántico Norte, y tienen el promedio de vida más largo de todas las especies vertebradas, ya que llegan a vivir varios cientos de años. Se cree que el espécimen más añoso jamás descubierto nació entre 1504 y 1744.
“Hace un par de años estudiamos sus tasas metabólicas por primera vez y hallamos que estos tiburones poseen un metabolismo extremadamente lento; cosa nada sorprendente, ya que son animales enormes y de sangre fría que viven en las heladas aguas del Ártico [el metabolismo se hace más lento conforme disminuye la temperatura corporal y aumenta la masa corporal]”, explica a Newsweek el Dr. Eric Ste Marie, ecologista marino e investigador de tiburones de Groenlandia en la Universidad de Windsor, Canadá. “Es muy probable que la lentitud de su metabolismo contribuya a la longevidad, aunque hacen falta más investigaciones al respecto”.
Aun así, las particularidades del entorno en que viven los tiburones de Groenlandia hacen improbable que su estrategia de longevidad resulte de alguna utilidad para los humanos.
“[Los humanos] somos mamíferos de sangre caliente, mientras que los tiburones de Groenlandia son peces de sangre fría. Por ello, es muy improbable que los procesos que contribuyen a su longevidad nos ayuden a vivir más tiempo”, concluye Ste Marie.

LA MEDUSA INMORTAL
Otro de los animales que parece tener la capacidad de vivir indefinidamente es la llamada “medusa inmortal” o Turritopsis dohrnii.
Con un tamaño de escasos 2 centímetros, este diminuto hidrozoo aparenta vivir eternamente, porque cuando sufre alguna lesión física, la medusa revierte a la primera etapa de su desarrollo, convirtiéndose en un pólipo genéticamente idéntico a la versión adulta. Esta proeza sería equivalente a la de una rana que, repentinamente, vuelve a ser un renacuajo.
Además, a decir del Museo Americano de Historia Natural, la medusa puede transformarse en pólipo incluso en periodos de escasez de alimento. Eso significa que —a menos de que algún pez la engulla— este cnidario puede vivir un tiempo extraordinariamente largo.
El proceso que permite esta forma de “resurrección” se denomina transdiferenciación, término que hace referencia a la capacidad de una célula especializada para cambiar a otro tipo celular; una transformación que no ocurre en las personas.
La transdiferenciación tiene enorme interés para la comunidad de investigadores científicos, ya que, de encontrar la manera de aplicar el proceso a un ser humano, sería posible reemplazar las células dañadas por alguna enfermedad.
LOS TARDÍGRADOS
Conocidos comúnmente como osos de agua, los tardígrados también poseen una versión propia de “inmortalidad”. Los minúsculos organismos, de escasos 0.2 milímetros de largo, son capaces de soportar condiciones de lo más adversas, ya que permanecen imperturbables en temperaturas muy altas o bajas, presiones extremas, altas dosis de radiación, condiciones de deshidratación e inanición e, incluso, sobreviven al vacío del espacio exterior.

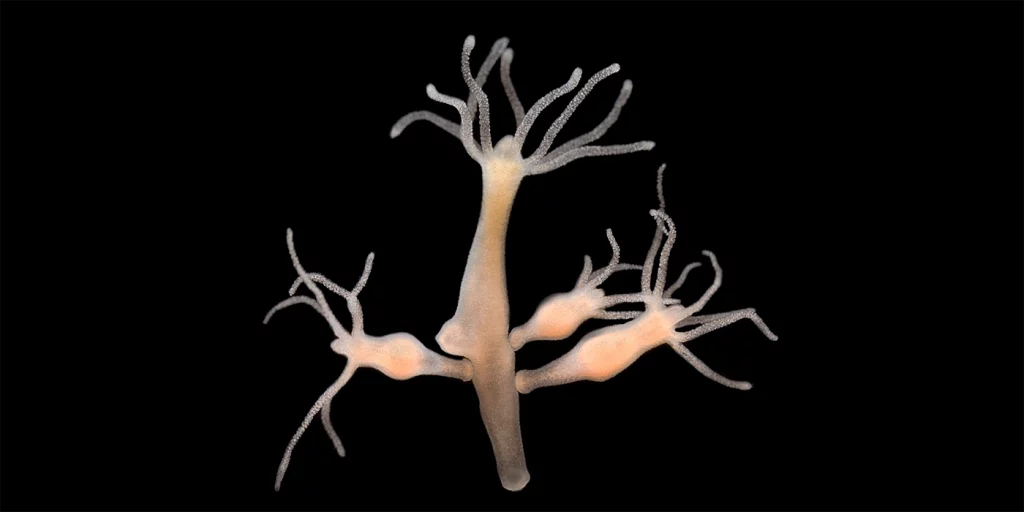
LA HIDRA
“La inmortalidad no existe en el mundo natural. Lo que podemos hallar son organismos que no pasan por un proceso de envejecimiento, como es el caso del pólipo de agua dulce Hydra vulgaris. No obstante, es preciso señalar que incluso estos hidrozoos mueren, si bien no a resultas del envejecimiento”, precisa el Dr. Gems.
Según un estudio publicado en 2015 en la revista Proceedings of the National Academy of Sciences, la hidra está dotada de gran cantidad de células madre y, por ello, pese al paso del tiempo, manifiesta muy pocos indicios de degradación celular o de senescencia.
“Por cuestiones que tienen que ver con el proceso evolutivo, los genes son los responsables del envejecimiento”, agrega el genetista. “Esto se debe a que la evolución se rige por un rígido esquema de ‘compre ahora y pague después’ y así, por ejemplo, el éxito reproductivo se paga con las enfermedades de la vejez. Desde esta perspectiva, los organismos que no envejecen carecen, simplemente, de un mecanismo integrado en su genética. Es decir, tal vez no tienen las condiciones necesarias para que la evolución les pase factura. Por lo anterior, no es factible activar en los humanos los mecanismos de no envejecimiento que poseen otros organismos”.
Por otra parte, igual que sus homólogos mitológicos, las hidras también son capaces de desarrollar una nueva cabeza cuando pierden la anterior: el apéndice faltante simplemente vuelve a crecer y el organismo no sufre la menor consecuencia.
HABILIDADES REGENERATIVAS DE LOS ANIMALES
Las salamandras y los ajolotes se cuentan entre las numerosas especies animales capaces de regenerar partes del cuerpo, ya que pueden volver a desarrollar las extremidades perdidas a causa de una lesión. A decir de los Institutos Nacionales de Salud de Estados Unidos (NIH), algunos turbelarios (planarias) poseen esta misma capacidad, pues podemos cortar uno por la mitad y el animal regenerará todo su cuerpo a partir de cada sección, creando así dos nuevos individuos.
“De hecho, la capacidad de regeneración es bastante común en el mundo natural, y está ampliamente distribuida en 35 filos animales (categoría taxonómica). Muchos son invertebrados marinos que poseen capacidades regenerativas increíbles. De ellos, los más conocidos son las anémonas de mar y los turbelarios, aunque también hay muchas otras especies como estrellas de mar, gusanos de bellota, moluscos, etcétera”, informa a Newsweek la Dra. Heather Marlow, profesora asistente de biología y anatomía organismal en la Universidad de Chicago.
La regeneración consiste en producir nuevos tejidos a partir de células nuevas, como hacen los fetos en el útero. “Esto lo consiguen desdiferenciando las células existentes e introduciendo la instrucción de dividirse y diferenciarse en tejidos nuevos”, prosigue Marlow.
Sin embargo, “también pueden lograrlo activando sus reservas de células madre para que respondan a las señales de lesión y se dividan formando los tejidos blandos que han perdido. Aun cuando no podemos comparar las células madre de una anémona de mar o de un turbelario con las células madre humanas, es muy importante estudiar los principios básicos sobre la forma como conservan sus poblaciones de células madres, cómo las activan y cuáles son los genes que intervienen en el desarrollo de estructuras regeneradas”, añade la especialista.
LAS SALAMANDRAS
Por qué y cómo las salamandras regeneran sus extremidades son temas de gran interés para la comunidad de biólogos que estudian la regeneración. “Algunos opinan que la regeneración se debe a la intervención de unos genes únicos y específicos (es decir, solo presentes en el genoma de las salamandras)”, señala el Dr. Igor Schneider, profesor asistente de regeneración de extremidades en la Universidad Estatal de Luisiana, en una declaración para Newsweek.
“Pero otros, entre ellos yo, creemos que las salamandras utilizan los mismos genes que todos poseemos. Aunque, a diferencia de nosotros, la expresión genética de las salamandras está dirigida a la regeneración”, agrega el académico.
Schneider prosigue: “Aun cuando hubiera una correlación entre la longevidad y la capacidad regenerativa —sobre todo en organismos capaces de regenerar todo el cuerpo—, la longevidad y la regeneración de partes del cuerpo son dos fenómenos distintos [que] evolucionan de manera independiente. Esto significa que algunas especies pueden vivir mucho tiempo, pero son incapaces de regenerar apéndices corporales (como sucede con algunos tiburones, que viven siglos, mas no pueden regenerar las aletas que pierden); mientras que otras regeneran las extremidades perdidas, pero su promedio de vida es muy corto”.
Hay muchas investigaciones dedicadas a las posibles aplicaciones humanas de esa capacidad para regenerar extremidades, ya que, a futuro, podrían brindar una mejor calidad de vida a las personas amputadas. “Equipos de científicos están trabajando en muchos frentes para encontrar la manera de regenerar una extremidad humana”, informa Schneider.
IDENTIFICAR CIERTOS GENES ANIMALES
En tanto, según afirma una investigación publicada en enero de 2022 en la revista Science Advances, “una vía de investigación muy prometedora es identificar los genes que codifican proteínas importantes para precipitar la regeneración en las salamandras. Esto, con la finalidad de producir cremas o biomateriales portátiles que contengan dichas proteínas o bien, fármacos que activen las vías de señalización para la regeneración. Hasta ahora, algunas de esas investigaciones han tenido un éxito parcial estimulando cierto grado de crecimiento regenerativo en ranas con patas amputadas”.
Interviene el catedrático de la Universidad Estatal de Luisiana: “Me parece que, a la larga, ese campo de investigación podría ser fructífero. Sin embargo, nadie sabe si el futuro de la terapia para humanos amputados se fundamentará en las prótesis sofisticadas con interfaces cerebro-máquina o en el desarrollo de medicamentos que promuevan el crecimiento de extremidades nuevas”.
Los animales disponen de tantas estrategias para vivir mucho más que el humano promedio que cabe la posibilidad de que, un día, podamos aplicar alguna de ellas para prolongar nuestras vidas. El gran inconveniente es que, dadas las enormes diferencias entre nuestros cuerpos y los cuerpos de los “animales inmortales”, ese objetivo se antoja muy difícil de lograr. Por ello, en vez de la inmortalidad, tal vez debamos conformarnos con hallar tratamientos para algunos padecimientos.
SOLO PROLONGAR LA VIDA
“Me parece que, a lo largo del próximo siglo, lo más que podremos conseguir con las terapias no genéticas (por ejemplo, fármacos) es prolongar nuestras vidas en 5 o 10 años (lo que, de cualquier manera, sería gran cosa… un beneficio muy superior al que obtendríamos, por ejemplo, con la erradicación total del cáncer)”, puntualiza Schneider. “El objetivo de vivir mucho más supone modificaciones genéticas muy extensas y complejas en la línea germinal, y eso podría ser factible dentro de muchos siglos (si no milenios), cuando el mundo sea política, ética y científicamente mejor que el actual”.
Eso sí, aun cuando descubramos la manera de vivir más tiempo, eso de ninguna manera impedirá que nos alcance la muerte. “Lo que debemos tener presente es que los esfuerzos para prolongar la vida humana no harán más que ralentizar o detener el envejecimiento, pero no nos volverán invulnerables a accidentes, lesiones ni enfermedades”, interpone el Dr. Davis.
“Prolongar la vida no es lo mismo que inmortalidad. Es verdad que, si podemos detener por completo el envejecimiento y seguimos viviendo como hasta ahora, lo más probable es que la muerte no sobrevenga con la edad (como sucede cuando envejecemos)”, añade el profesor de filosofía y bioética.
“Lo que es indiscutible es que moriremos de algo. Porque, aunque no envejezcas, corres el riesgo de que un autobús te atropelle esta tarde, o de que mueras de una enfermedad desconocida dentro de 10,000 años. Todo se reduce a las probabilidades”, concluye. N
—∞—
(Publicado en cooperación con Newsweek. Published in cooperation with Newsweek).
















































